En 1988, le médecin Gerald Reaven, endocrinologue et professeur à l’Université Stanford, a révolutionné le domaine de la santé en parlant d’« insulinorésistance », c’est-à-dire d’un corps qui répond moins bien à l’insuline, ce qui peut mener à plusieurs troubles métaboliques, tels que:
- L’accumulation de graisse abdominale
- Diabète de type 2
- Maladies cardiovasculaires
- L’accumulation de gras dans le foie
- Syndrome des ovaires polykystiques (SOPK, PCOS en anglais)
Il a appelé cet ensemble de troubles le « syndrome X », que l’on connaît aujourd’hui sous le nom de syndrome métabolique.
Qu’est-ce que le métabolisme?
Le métabolisme désigne l’ensemble des réactions biochimiques par lesquelles l’organisme transforme les nutriments de notre alimentation en énergie utilisable par les cellules. [1]
Il comprend:
- Le catabolisme: dégradation des molécules pour libérer de l’énergie
- L’anabolisme: utilisation de cette énergie pour synthétiser des molécules plus complexes.
Le métabolisme assure la production d’énergie nécessaire et soutient l’ensemble des fonctions de l’organisme.
Qu’est-ce que le syndrome métabolique?
Le syndrome métabolique, aussi connu sous le nom de dysfonction métabolique, c’est quand le corps n’arrive plus à bien produire et gérer son énergie.
Des études récentes publiées dans « Nature Reviews » [2] montrent que quand les signaux métaboliques sont déréglés, l’équilibre de l’énergie se dégrade dans plusieurs systèmes du corps.
La dysfonction métabolique découle souvent d’une défaillance mitochondriale, où les « centrales énergétiques » des cellules ne fonctionnent plus correctement.
Les mitochondries sont de petites structures dans les cellules qui transforment les nutriments en adénosine triphosphate (ATP), la molécule que les cellules utilisent comme carburant immédiat pour faire fonctionner le corps.
On les appelle les « centrales énergétiques de la cellule ». [3] L’ATP, c’est la « monnaie énergétique » du corps, produite par ces centrales.
Quand les mitochondries tournent au ralenti, elles produisent moins d’ATP. Résultat: les cellules manquent d’énergie et les fonctions de base du corps deviennent plus lentes et moins efficaces.
En plus de produire de l’énergie, les mitochondries servent aussi de centre de contrôle. Elles détectent si les nutriments sont disponibles, si le corps est stressé et comment le système immunitaire réagit. Quand elles sont perturbées, ça crée une sorte de crise énergétique dans les cellules, qui peut entraîner de l’inflammation, des tissus qui fonctionnent moins bien et avec le temps, des maladies métaboliques.
La dysfonction métabolique touche aussi la façon dont le corps gère le glucose et les acides gras. Le corps peut avoir du mal à garder une glycémie stable ou à utiliser correctement le gras stocké, ce qui peut amener des variations d’énergie et une prise de gras plus facile.
L’équilibre hormonal joue aussi un rôle crucial. Des hormones comme l’insuline, la leptine et le cortisol coordonnent l’appétit, le stockage de l’énergie et la réponse au stress. Quand ces hormones sont déréglées, le corps peut entrer dans un état de déséquilibre énergétique chronique, avec une sensation de fatigue tout en étant incapable de brûler efficacement les graisses, ou une faim quasi constante malgré un apport calorique suffisant.
Enfin, la dysfonction métabolique altère souvent la flexibilité métabolique, c’est-à-dire la capacité du corps à passer facilement de l’utilisation des glucides à celle des graisses selon les besoins. Lorsque cette flexibilité est perdue, la production d’énergie devient moins efficace et dépend fortement des pics de sucres.
On peut parler de dysfonction métabolique avec plusieurs termes apparentés ou quasi synonymes:
- Dysfonction métabolique
- Fonction mitochondriale altérée
- Métabolisme déréglé
- Dysfonction mitochondriale
- Dérèglement métabolique
- Anomalies métaboliques
- Dysrégulation métabolique.
Quels sont les critères du syndrome métabolique?
Au début des années 2000, le « Adult Treatment Panel III (ATP III)« , troisième ensemble de recommandations cliniques publié par le « National Cholesterol Education Program (NCEP) » aux États-Unis, a proposé une série de critères pour définir et diagnostiquer le syndrome métabolique.
Selon l’ATP III, le syndrome métabolique est défini par la présence d’au moins trois des critères suivants :
- Tour de taille augmenté
- Hommes : >40 po ou >102 cm
- Femmes : >35 po ou >88 cm
- Triglycérides élevés
- ≥150 mg/dL ou ≥1.69 mmol/L
- HDL-cholestérol bas
- Hommes : <40 mg/dL ou <1.03 mmol/L
- Femmes : <50 mg/dL ou <1.29 mmol/L
- Tension artérielle élevée
- ≥130/85 mmHg
- Glycémie à jeun élevée
- ≥110 mg/dL ou ≥6.11 mmol/L
L’objectif de ces critères est d’aider les médecins à repérer plus facilement les personnes à haut risque cardiovasculaire en raison d’un ensemble de problèmes métaboliques qui se cumulent.
Gerald M. Reaven, qui avait décrit ce tableau sous le nom de «Syndrome X», insistait toutefois sur une idée centrale: le noyau du problème est la résistance à l’insuline, avec une hyperinsulinémie compensatoire qui fait monter la glycémie, les triglycérides et la pression artérielle et qui fait baisser le HDL.
Signes concrets d’une dysfonction métabolique au quotidien
Voici quelques signes concrets qui peuvent indiquer que ton métabolisme commence à foirer:
- Fatigue chronique, surtout après les repas
- Faim rapide après avoir mangé, “crash” d’énergie, envies de sucre
- Difficulté à perdre du gras malgré un déficit raisonnable
- Tour de taille qui augmente avec le temps
- Tension artérielle qui monte progressivement
- Sommeil de mauvaise qualité, ronflement / apnées possibles
- Marqueurs inflammatoires souvent un peu élevés (ex: CRP hs)
Mitochondries: les centrales énergétiques sous attaque
Lorsque les mitochondries sont endommagées ou deviennent dysfonctionnelles, à cause des carences en nutriments, une mauvaise alimentation, le stress oxydatif, l’inflammation chronique, des facteurs comme les toxines environnementales ou le vieillissement naturel, la production d’ATP diminue.
Ce déficit énergétique peut se manifester par une fatigue persistante, des problèmes cognitifs comme le brouillard mental et la difficulté à se concentrer, une faiblesse musculaire et un ralentissement de la réparation et de la régénération cellulaires.
La dysfonction mitochondriale sur le long terme
La dysfonction mitochondriale est de plus en plus reconnue comme une cause profonde de plusieurs maladies chroniques, notamment les troubles neurodégénératifs (comme la maladie d’Alzheimer, la maladie de Parkinson), le syndrome métabolique (caractérisé par la résistance à l’insuline, l’obésité et le diabète de type 2), les maladies cardiovasculaires et même le cancer.
Si tes cellules ne peuvent pas fonctionner normalement, à cause d’une mauvaise alimentation, du stress et de l’inflammation, avec le temps ça crée un déficit d’énergie et ça dérègle la réparation cellulaire, ce qui contribue graduellement au développement de maladies.
Avec le temps, ces dommages cumulatifs peuvent compromettre la fonction des tissus, accélérer le vieillissement et favoriser la progression des maladies chroniques.
Immunité et métabolisme
Pendant des millions d’années, l’immunité et le métabolisme se sont adaptés pour combattre les infections et stocker l’énergie. Mais avec la médecine moderne et de meilleures conditions de vie, les infections ont beaucoup reculé, et ce sont maintenant surtout les maladies chroniques liées au mode de vie, comme la sédentarité, l’obésité et les problèmes métaboliques, qui causent la majorité des décès dans les pays développés.
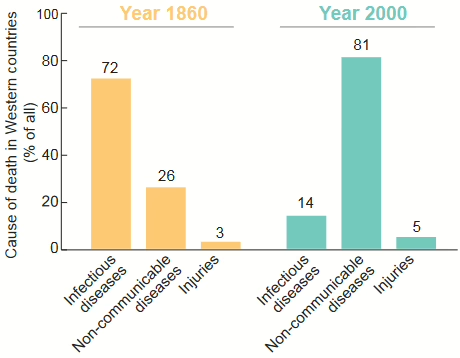
Métaflammation: le feu silencieux à l’intérieur
Le terme «metaflammation» a été introduit pour la première fois en 2008 pour décrire un état inflammatoire chronique de faible intensité associé aux troubles métaboliques. Ce concept a été largement exploré par des chercheurs comme le Dr Gökhan Hotamisligil, qui a contribué de façon majeure au domaine de l’immunométabolisme.
La métaflammation (« Metaflammation ») est alimentée par un déséquilibre métabolique qui ne provoque pas de douleur comme une inflammation aiguë, mais elle détériore la santé avec le temps. [4] Elle est particulièrement active dans des tissus comme le foie, le tissu adipeux et le cerveau.
Comme cette forme d’inflammation n’a pas de symptômes évidents, ses effets néfastes sur la fonction des cellules et des organes passent souvent inaperçus. L’obésité, la suralimentation, la sédentarité, le vieillissement, le stress et le manque de sommeil peuvent tous contribuer à la métaflammation.
L’équilibre entre catabolisme et anabolisme
Ensemble, le catabolisme et l’anabolisme forment l’équilibre métabolique qui permet au corps de rester fort et adaptable. C’est une interaction dynamique qui s’ajuste constamment selon les besoins énergétiques, la disponibilité des nutriments et les signaux hormonaux. [5]
Le mot catabolisme vient du grec, où «kata» signifie vers le bas et «ballein» jeter, autrement dit, la dégradation.
Le catabolisme, c’est la dégradation des molécules que tu as ingérées, par exemple:
- l’amidon → sucres plus simples
- les gras → acides gras
- protéines → acides aminés
durant la digestion et la production d’énergie dans les cellules, afin de libérer de l’énergie.
Ça peut aussi être l’action d’aller puiser dans tes réserves et parfois dans tes tissus, comme le glycogène, la graisse et même le muscle, quand ta demande en énergie dépasse ce que tu as consommé, par exemple lors d’exercices intenses, pendant un jeûne ou en situation de famine.
Qu’est-ce que l’anabolisme? Le mot anabolisme, quant à lui, vient du grec, où «ana» signifie vers le haut et «ballein» jeter, donc l’idée de «jeter vers le haut», construire.
L’anabolisme, c’est quand le corps utilise ce qu’il a pour construire et réparer des tissus et aussi pour emmagasiner de l’énergie pour plus tard, par exemple en glycogène ou en graisse.
Dans un métabolisme en santé, les processus cataboliques et anaboliques maintiennent l’homéostasie, et ces mécanismes sont finement réglés: tu décomposes efficacement les nutriments pour produire de l’énergie, tout en construisant et en réparant les tissus au besoin.
Toutefois, une dysfonction métabolique vient perturber cet équilibre. Avec le temps, ce déséquilibre contribue à un vieillissement accéléré, une cicatrisation plus lente, une résilience diminuée face aux infections et une dégradation globale de la santé métabolique.
Restaurer l’équilibre métabolique
Restaurer l’équilibre métabolique demande de s’attaquer aux causes profondes de la dysfonction.
Sédentarité, alimentation inadéquate, surpoids et obésité abdominale, tabagisme et alcool, résistance à l’insuline, dysfonction mitochondriale, déséquilibre du microbiote intestinal, inflammation chronique, génétique et hérédité, vieillissement, pollution et agents toxiques, manque de sommeil et stress, apnée du sommeil, stéatose hépatique (foie gras) sont tous des facteurs qui alimentent la dysfonction métabolique et augmentent le risque de complications à long terme.
Certains facteurs sont hors de notre contrôle, comme la génétique, l’âge ou une partie de notre environnement, mais ceux qui ont souvent la plus grande influence au quotidien, on peut les contrôler: l’alimentation, le sommeil, l’activité physique, le stress et nos habitudes de vie.
L’homéostasie énergétique et l’orchestre biochimique
Le corps surveille et ajuste constamment son statut énergétique interne grâce à des hormones comme l’insuline, la leptine et le cortisol. Ces signaux régulent la faim, le stockage des graisses et la dépense énergétique. Lorsque ce système se dérègle (style de vie, certains types d’alimentation, inactivité, inflammation chronique), le résultat est un chaos métabolique: fringales, prise de poids et faible niveau d’énergie.
Fonctions principales des hormones du métabolisme
L’insuline est une hormone produite par le pancréas dont le rôle principal est de réguler le taux de sucre (glucose) dans le sang (glycémie). Après un repas, l’insuline permet aux cellules (muscles, foie, adipeux) d’absorber le glucose pour l’utiliser comme énergie ou de le stocker sous forme de glycogène (foie/muscles) ou de graisse (tissu adipeux).
Surnommée « l’hormone de la satiété », la leptine est principalement produite par les cellules adipeuses (cellules graisseuses). Elle agit sur le cerveau pour signaler la satiété et supprimer l’appétit, aidant ainsi à réguler l’équilibre énergétique et le poids corporel.
Surnommée « l’hormone de la faim », la ghréline est surtout produite par l’estomac. Elle stimule l’appétit et favorise la prise alimentaire en agissant sur le cerveau, signalant qu’il est temps de manger.
Souvent appelée « l’hormone du stress », le cortisol est produit par les glandes surrénales en réponse au stress physique ou psychologique. Il joue un rôle crucial dans la mobilisation de l’énergie en augmentant la glycémie, modifie la réponse immunitaire et aide l’organisme à faire face aux situations difficiles. Il suit également un rythme circadien, avec un pic le matin pour favoriser l’éveil.
Et bien sûr, l’insuline, la leptine, la ghréline et le cortisol ne sont qu’une partie du portrait, car plusieurs autres hormones participent aussi au métabolisme, comme le glucagon, les hormones thyroïdiennes (T3/T4), l’adrénaline, l’aldostérone, le GLP-1, la testostérone et l’œstradiol, entre autres.
Comment l’inflammation perturbe la signalisation métabolique
Quand l’inflammation reste élevée trop longtemps, elle brouille les signaux qui contrôlent la faim, la satiété et la glycémie. Résultat: ton corps répond moins bien, donc il doit produire plus d’hormones pour obtenir le même effet. Avec le temps, ça entretient un cercle vicieux qui favorise les fringales, la fatigue, une énergie instable et la prise de poids, même quand tu fais attention à ton alimentation.
En bref, l’inflammation agit comme du «bruit» dans le système de communication du corps: les messages passent moins bien, alors tout devient plus difficile à réguler.
Le lien immuno-métabolique
Notre système immunitaire et notre métabolisme sont étroitement liés. Les cellules immunitaires dépendent de carburants métaboliques et une dysfonction métabolique affaiblit les défenses immunitaires.
L’inflammation chronique détourne les ressources métaboliques, en les éloignant de la guérison et de la régénération, pour les orienter vers les réponses immunitaires. Cela peut mener à une plus grande vulnérabilité aux infections, aux maladies auto-immunes et à une récupération plus difficile.
Le métabolisme et la gestion de l’énergie
Le métabolisme, c’est la gestion de l’énergie: comment ton corps l’acquiert, la digère, l’utilise, la stocke, la mobilise et la dissipe.
Le syndrome métabolique est diagnostiqué lorsqu’une personne présente au moins trois des cinq critères suivants: tour de taille élevé, triglycérides élevés, HDL bas, glycémie à jeun élevée et pression artérielle élevée. Chaque facteur augmente le risque de maladie cardiovasculaire, de diabète de type 2 et d’AVC, mais le fait d’en cumuler trois ou plus augmente ce risque de façon marquée. Il faut voir ce diagnostic comme un signal d’alarme pour modifier certains aspects de sa santé afin de réduire le risque futur.
Les causes de la dysfonction mitochondriale
La dysfonction mitochondriale peut avoir plusieurs causes, comme des carences en nutriments, l’exposition à certaines toxines, des infections qui traînent ou un stress qui dure trop longtemps. La génétique et certains médicaments peuvent aussi nuire au bon fonctionnement des mitochondries et à la production d’énergie.
Comme les mitochondries sont présentes dans presque toutes les cellules, une dysfonction mitochondriale peut toucher plusieurs systèmes en même temps. Les signes fréquents incluent la fatigue, une faiblesse ou des douleurs musculaires, le brouillard mental, une mauvaise tolérance à l’exercice, des problèmes neurologiques ou digestifs et une tendance à attraper des infections plus facilement.
Beaucoup de gens vivent peut-être avec une dysfonction mitochondriale cachée sans le savoir parce qu’elle peut se manifester de plusieurs façons en même temps. Une personne peut être malade en permanence, une autre peut avoir de la difficulté à dormir, tandis qu’une autre remarque que sa digestion se détériore, et souvent plusieurs systèmes déclinent ensemble.
Comme les mitochondries fournissent l’énergie cellulaire qui soutient chaque système du corps, des problèmes dans différentes sphères peuvent indiquer que la production d’énergie globale est en baisse. Plutôt que de courir après des dizaines de problèmes isolés, l’idée est de remonter à la source en identifiant ce qui affaiblit la fonction mitochondriale.
Conclusion
Un enfant en santé, c’est comme une pile neuve. Ses mitochondries sont un système énergétique très performant, qui s’adapte vite et qui peut gérer pas mal n’importe quel carburant. Même si l’enfant mange parfois de la cochonnerie, le système est tellement robuste qu’il revient vite à l’équilibre. Résultat, une énergie inépuisable, une récupération rapide et une croissance qui se fait d’elle-même.
Avec les années, c’est là que ça change. À force d’abuser des bonnes choses, pics de glucose répétés, stress chronique, manque de sommeil, inactivité, inflammation, alcool, la machinerie s’use. Les mitochondries deviennent moins efficaces à produire l’ATP.
Quand la production d’énergie baisse, le corps commence à couper dans ce qui coûte le plus cher: la performance et la récupération, la clarté mentale, puis la stabilité de la glycémie et de l’appétit, parce que la régulation hormonale devient moins efficace; avec le temps, le sommeil, la digestion, l’humeur et même l’immunité en écopent, pendant que le stress oxydatif et l’inflammation montent en arrière-plan.
Il y a des bases qui aident presque tout le monde: bouger davantage, dormir mieux, réduire le stress et revenir à des aliments simples. Là où je vois souvent une différence majeure, c’est dans le choix du carburant. En diminuant les glucides de moins bonne qualité, en augmentant les protéines et en donnant au corps assez de bons gras, tu réduis les montagnes russes de glucose et d’insuline, tu stabilises ton énergie et tu aides tes hormones à faire leur travail plus efficacement.
Malheureusement, aujourd’hui, on mange souvent d’abord pour le plaisir, les saveurs et les “hits” de dopamine que certains produits transformés procurent. En même temps, on reste pris dans un vieux paradigme qui diabolise les gras et qui pousse à limiter les protéines animales. Ce sont des idées qui ne tiennent plus vraiment la route, mais elles sont encore enseignées et promues dans plusieurs sphères de la société, ce qui entretient la confusion et nous éloigne de l’essentiel: nourrir le corps avec des aliments qui soutiennent l’énergie, la satiété et la santé à long terme.
Recherches et références
[1] Liu H, Wang S, Wang J, Guo X, Song Y, Fu K, Gao Z, Liu D, He W, Yang LL. Energy metabolism in health and diseases. Signal Transduct Target Ther. 2025 Feb 18;10(1):69. doi: 10.1038/s41392-025-02141-x. PMID: 39966374; PMCID: PMC11836267. https://www.nature.com/articles/s41392-025-02141-x
Energy metabolism is indispensable for sustaining physiological functions in living organisms and assumes a pivotal role across physiological and pathological conditions. This review provides an extensive overview of advancements in energy metabolism research, elucidating critical pathways such as glycolysis, oxidative phosphorylation, fatty acid metabolism, and amino acid metabolism, along with their intricate regulatory mechanisms. The homeostatic balance of these processes is crucial; however, in pathological states such as neurodegenerative diseases, autoimmune disorders, and cancer, extensive metabolic reprogramming occurs, resulting in impaired glucose metabolism and mitochondrial dysfunction, which accelerate disease progression.
[2] Zong Y, Li H, Liao P, Chen L, Pan Y, Zheng Y, Zhang C, Liu D, Zheng M, Gao J. Mitochondrial dysfunction: mechanisms and advances in therapy. Signal Transduct Target Ther. 2024 May 15;9(1):124. doi: 10.1038/s41392-024-01839-8. PMID: 38744846; PMCID: PMC11094169. https://www.nature.com/articles/s41392-024-01839-8
Mitochondria, with their intricate networks of functions and information processing, are pivotal in both health regulation and disease progression. Particularly, mitochondrial dysfunctions are identified in many common pathologies, including cardiovascular diseases, neurodegeneration, metabolic syndrome, and cancer.
[3] Bhatti JS, Bhatti GK, Reddy PH. Mitochondrial dysfunction and oxidative stress in metabolic disorders – A step towards mitochondria based therapeutic strategies. Biochim Biophys Acta Mol Basis Dis. 2017 May;1863(5):1066-1077. doi: 10.1016/j.bbadis.2016.11.010. Epub 2016 Nov 9. PMID: 27836629; PMCID: PMC5423868. https://www.sciencedirect.com/science/article/pii/S0925443916302927
Mitochondria are the powerhouses of the cell and are involved in essential functions of the cell, including ATP production, intracellular Ca2 + regulation, reactive oxygen species production & scavenging, regulation of apoptotic cell death and activation of the caspase family of proteases. Mitochondrial dysfunction and oxidative stress are largely involved in aging, cancer, age-related neurodegenerative and metabolic syndrome. In the last decade, tremendous progress has been made in understanding mitochondrial structure, function and their physiology in metabolic syndromes such as diabetes, obesity, stroke and hypertension, and heart disease.
[4] Metaflammation
https://gsh.hsph.harvard.edu/metaflammation
Metabolism is the most ancient and fundamental process in all living history. Metabolism is the combination of all chemical reactions that occur within cells, ensuring proper function and survival. As such, proper metabolic functioning is paramount for overall health.
https://www.cell.com/immunity/fulltext/S1074-7613(17)30367-9
Highly ordered interactions between immune and metabolic responses are evolutionarily conserved and paramount for tissue and organismal health. Disruption of these interactions underlies the emergence of many pathologies, particularly chronic non-communicable diseases such as obesity and diabetes.
[5] Schwartsburd PM. Catabolic and anabolic faces of insulin resistance and their disorders: a new insight into circadian control of metabolic disorders leading to diabetes. Future Sci OA. 2017 Jun 26;3(3):FSO201. doi: 10.4155/fsoa-2017-0015. PMID: 28884000; PMCID: PMC5583684. https://pmc.ncbi.nlm.nih.gov/articles/PMC5583684/
Maintenance of glucose homeostasis during circadian behavioral cycles is critical. The processes controlling the switch between predominant lipolysis/fatty oxidation during fasting and predominant lipid storage/glucose oxidation following feeding are determined principally by insulin. Chronic elevated threshold of insulin resistance (IR) is a key pathological feature of obesity, Type 2 diabetes, sepsis and cancer cachexia; however, a temporal reduced threshold of IR is widely met in fasting/hibernation, pregnancy, antibacterial immunity, exercise and stress.



Laisser un commentaire